- 852+ 2891 9689
- [email protected]
- 香港九龍尖沙咀柯士甸道 29 號六樓
移植毛囊從供區到脫髮區,不代表一定會成功生長。一旦毛囊受損,就無法再次生長。因此,每一步手術細節都需精準無誤,才能提升成活率。平均 85%–92% 毛囊在植入後能成功存活並長出新髮。
專業提醒:毛囊移植是否成功,並非「種下去就會長」那麼簡單。
每一步操作 —— 從提取、保存、到植入與術後管理,皆需精準控制,才能提升毛囊成活率與自然外觀。
造成毛囊死亡的因素主要分為兩類:X 型損害因子(X-Killing Factors); H 型損害因子(H-Killing Factors)。
“X” 代表「未知因素」,此概念最早由澳洲的 Dr. Shield 於 1984 年提出,用以解釋某些毛囊移植後無法生長的情況。初期僅佔失敗案例的 0.5–1%;隨植髮技術標準化後,大多數不理想成果其實都與 X 因素有關。我們認為這些「未知因素」其實是手術過程中及術後造成的生物性損害。
我們的觀點:這些「未知因素」其實是手術當中或術後造成的生物性損傷,可透過經驗、技術與術後管理加以預防。
H 代表「Human(人為因素)」- H-Factor 是指由操作人員疏忽、病人習慣或術中技術問題所導致的毛囊損傷
可在手術前、手術中、或術後發生。因此,植髮結果無法 100% 保證,惟透過專業團隊、正確流程與完善管理,可大幅降低風險。
可能影響毛囊存活的身體狀況與生活習慣包括:
即使手術順利,若技術不當,也可能損害毛囊:
移植後的毛囊受到損傷;
毛囊是有生命的組織 – 當毛囊被移植到新位置後,體內會發生一連串生物化學變化,理解這些自然組織與化學過程,有助於提升毛囊存活率與最終效果。
植髮株從供區取出後,會被暫時放置於保存液中,等待植入受區。在此期間,原有的血液供應已被切斷,氧氣迅速耗盡,廢物也開始累積。
因此,植髮株能否成功從受區獲取養分並重新建立血管循環(再血管化),將直接決定其存活率。
傷口癒合階段的生理反應,一旦植入完成,身體會啟動自我修復機制,出現一連串細胞反應與生理變化,包括:
– 水腫(Edema);
– 泛紅(Erythema);
– 原有頭髮脫落(Shedding);
– 新生頭髮長出(Regrowth);
– 毛囊再血管化(Revascularization)。
在美絲植髮,我們始終堅持一個核心原則:「數量不是重點,品質才是關鍵。」每一個步驟皆以 提升毛囊存活率 為最高目標,確保每一根移植的毛囊能健康生長、持久自然。
毛囊存活率的醫學基礎與臨床意義 : 人體出生後,毛囊數量固定,無法再生;後枕部的永久毛囊(供區)為不可替代資源,許多人期待「毛囊複製技術」能解決資源限制,但至今仍未實現。因此,植髮時減少毛囊損傷與浪費, 是目前最重要的課題。
超過 50 年的臨床研究結論 – 過去半個世紀以來,全球已有眾多研究深入探討植髮後毛囊的實際存活率與生長百分比,主要結論如下:
最終成果取決於毛囊實際再生數量 → 著名植髮醫師 Dr. Beehner 指出:決定植髮成功與否的關鍵,不是移植了多少毛囊,而是有多少真的長出來。
專業團隊技術,遠比數量更重要,植髮團隊的經驗與技術,直接決定毛囊存活率。醫生與技術人員不能只關注提取毛囊的數量,更要注重植入後的生長與保護,移植本身只是第一步,要避免 H 因素(人為傷害)與 X 因素(未知風險)才能保障生長。
多數診所按「 植入株數 」收費,不是「 成功生長株數 」;高毛囊存活率可降低總體植髮次數與費用。
記住:金錢可以再賺,但被浪費的供區毛囊無法重來。
A 中心 |
B 中心 |
|
|---|---|---|
| 每株費用 ( HKD ) | 25 | 25 |
| 植入數量 | 2,400 株 | 2,400 株 |
| 成本總計 (HKD) | 60,000 | 60,000 |
| 毛囊橫切率(毛囊損傷) | 20% | 2% |
| 損傷毛囊數量 | 2,400 X 20% = 480 | 2,400 X 2% = 48 |
| No. of Intact Graft | 2,400 - 480 = 1,920 | 2,400 - 48 = 2,352 |
| 每株實際毛囊成本 (HKD) | 60,000 ÷ 1,920 = 31 | 60,000 ÷ 2,352 = 25.5 |
結論:高橫切率會提高每株毛囊的實際成本。

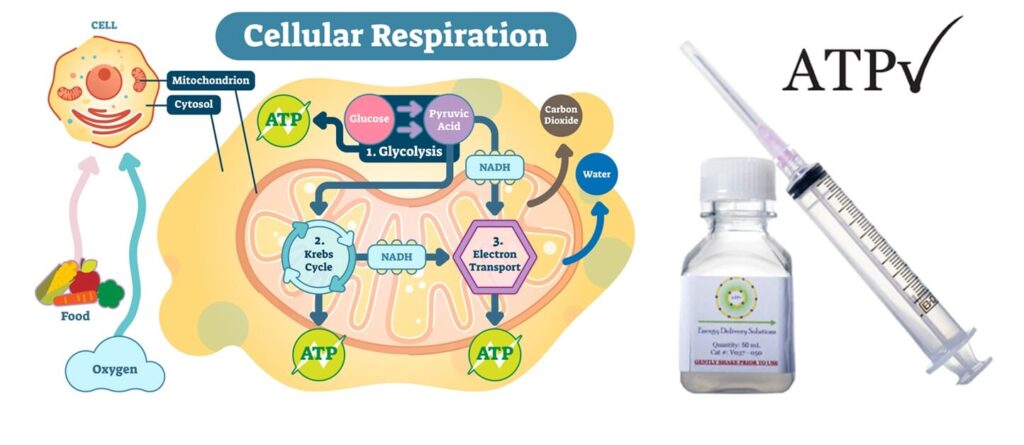
ATP(三磷酸腺苷)是人體細胞的能量分子,能啟動各種生理反應。缺乏 ATP 會導致細胞受損,甚至死亡。特別是在手術後,組織暫時缺氧,會導致 ATP 減少,影響傷口癒合與毛囊生長。
為什麼植髮後需要 ATP?
– 促進毛囊細胞修復與再生;
– 維持細胞活性,減少移植後壞死風險;
– 改善再血管化,加速恢復與生長;
– 適用於手術傷口、延遲癒合個案與植髮病人。
傳統 ATP 水溶液無法被細胞有效吸收 – 脂質體包裹技術(Liposome Delivery),可將 ATP 成分直接輸送進入細胞。
此項技術由美國路易斯維爾大學 William Ehringer 教授於 2002 年研發,歷經十年實驗,於 2012 年創立 Energy Delivery Solutions 公司,現已廣泛應用於術後修復、慢性傷口癒合及毛囊移植醫學。
國際醫學專家實證有效 : 美國 Dr. Cooley 及我們的醫療顧問 Dr. Pathomvanich 皆證實,在植髮手術中使用脂質體 ATP(Lyposomal ATP),能:
– 加速傷口癒合;
– 明顯提升毛囊成活率與生長結果。
2015 年,美絲植髮創辦人伍文輝醫生親自拜訪 ATP 發明人 Dr. Ehringer,與 Dr. Cooley 一同建議以下應用方式:
1. 手術期間:將毛囊保存在含 ATP 的保存液中;
2. 術後居家護理:前 48 小時(最多可持續 5 天)每日噴灑 ATP 配方於受區頭皮上。
臨床觀察成果: 經過一年以上的試驗觀察,結果令人驚艷,自 2016 年 10 月起,本中心為所有植髮病人常規使用脂質體 ATP;由於 ATP 半衰期極短,必須每數週從美國空運新鮮配方,我們堅持高品質,即使成本更高、過程繁瑣。
美國進口 Tricomin 銅胜肽毛囊噴霧,搭配術後護理,提升整體植髮成果。

來自美國的 Tricomin Follicle Spray,含 Copper Nutritional Complex(銅營養複合物),僅使用美國原裝進口產品,確保品質穩定、安全有效。
術後 4 個月內可能出現的常見反應:
– 植髮手術對頭皮產生創傷,可能導致暫時性脫髮(Shock Loss);
– 少數患者會出現移植區輕微腫脹、發紅或不適感;
– 新植入的毛囊可能在初期難以適應新環境,導致延遲生長或暫停期。
激光育髮技術可活化細胞內的粒線體,促進能量產生,強化脆弱毛囊。激光進入細胞後被粒線體吸收
刺激三磷酸腺苷(ATP)的生成,這是毛囊細胞進行生長的主要能量形式。對於處於虛弱或創傷恢復期的毛囊,充足的能量供應至關重要,可促進毛囊細胞修復、增生與再生,有助於毛髮更穩定生長。

臨床認證、全球實證、有效提升毛囊存活率,全球超過數千間植髮中心(如 Bosley、HairClub)廣泛使用
美國 FDA 認證技術,現已引入本中心,專為術後使用。有別於市面廉價 LED 手持儀器,真正能深入毛囊底層,激活粒線體。
每次療程僅需 20 分鐘,喚醒細胞能量中心、打造更強韌毛囊、活化細胞內粒線體、促進 ATP 能量生成、
增強移植毛囊存活能力、提高轉化為健康終末毛髮的機率。
額外存活毛囊 = 更濃密自然的成果 : 你看不到的細節,決定最終的成敗,存活的「額外毛囊」將轉化為粗壯、自然的毛髮,提高整體密度與分佈均勻性,減少休止期脫髮,讓您更快看見成效。
術中不可忽視的風險,直接影響成效與成本:當植髮過程中使用器械角度或深度不正確,可能切斷或損傷毛囊;被截斷的毛囊失去底部幹細胞與真皮乳突,無法重新生長新髮,嚴重截斷會大幅降低植髮存活率、造成浪費。
一旦毛囊被截斷,其重新長出健康毛髮的能力將顯著降低——甚至完全喪失——導致毛囊存活率低及供區資源浪費。要將截斷率降至最低,需要精準的技術、豐富的經驗,以及在適當放大倍率下使用精細儀器。
因此,外科技巧與技術在實現持久、自然成果中扮演關鍵角色。
部分截斷後的毛囊存活率
促進毛囊再生的幹細胞存在於毛囊周圍的組織中,去除毛囊周圍過多組織也是一種物理性損傷。
Seager 在 1997 年報導:「胖毛囊」(脂肪多)比「瘦毛囊」(脂肪少)有較佳存活率。
Beehner 在 2010 年指出:差異在於胖毛囊保留了幹細胞,而瘦毛囊在修剪過程中將幹細胞去除。
脫水會造成嚴重毛囊損傷:Gandelman:毛囊乾燥超過 5 分鐘,細胞結構開始產生不良變化;Kim:毛囊暴露於空氣超過 10 分鐘,將有超過 6% 死亡;超過 20 分鐘後,存活率急劇下降。
插入過程可能需時 4–8 小時,經過的時間對毛髮生長與存活率至關重要,時間越長,存活率越低,隨著氧氣耗盡,二氧化碳、糖分、尿素等廢物積累,新植入的毛囊將進入酸中毒狀態。
植入後的 48–96 小時為關鍵期 – 若血液循環未能成功重建(初次血管吻合),則毛囊無法糾正代謝失衡,將導致死亡。
提取後經過的時間( 小時 ) |
% 毛囊生長率 |
|---|---|
| 2 | 95 |
| 4 | 90 |
| 6 | 86 |
| 8 | 86 |
| 24 | 79 |
從表格中可見,毛囊存活率在 4 小時後下降至 90%。換言之,超過 4 小時後,將有 10% 的提取毛囊無法生長毛髮。由於人生中的供區毛髮數量有限,這些未能成長的毛囊即為浪費。
這是一種物理性損傷 – 研究指出所有冷凍的毛囊都會死亡,家用冰箱的溫度可能會波動,若溫度設定過低可能不知不覺間降至 0°C 以下,導致毛囊死亡。Kim 的研究指出:在 6 小時內,不論將毛囊儲存在室溫或 4°C,存活率無顯著差異。
– 若可在 4–6 小時內完成手術,將毛囊儲存於室溫;
– 使用特殊儲存液(Hypothermosol)將毛囊置於冰箱;
– 儘量於 6 小時內完成植入程序。
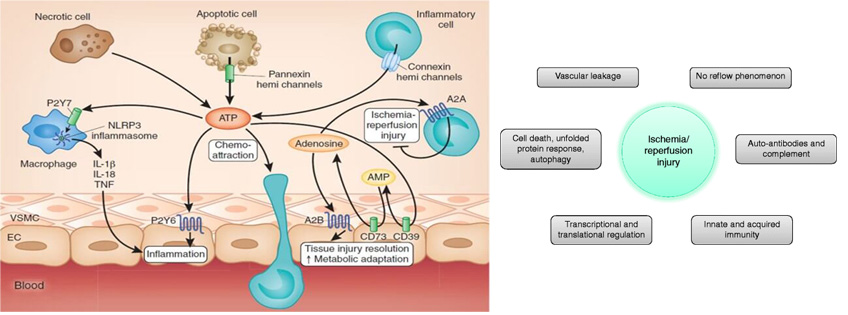
當毛囊經歷低氧環境一段時間後,在植入過程中重新暴露於氧氣中,可能會產生自由基。這些自由基可能導致細胞損傷及毛髮生長不良,這種現象稱為「缺血再灌流損傷」( Ischaemic Reperfusion Injury, IRI )。

將毛囊從一個位置移植到另一個位置,並不保證一定有好結果。由於受損的毛囊無法再生,醫生必須在每一個步驟、每一個細節上都保持高度注意。
國際專業認證
美絲是香港及中國大陸現今植髮界中最具資歷的植髮中心之一,獲多個國際醫學機構專業認可。 我們秉持最高的專業操守、為受脫髮困擾人士,提供最安全和有效的醫療解決方案。
植髮是改善髮線上移頭髮稀疏的終極解決方案,但並非每個人都適合。
我們的線上評估有助於確定這些程序是否適合您,從而節省您的求診的時間和成本。